22.07.2022 r.
Naukowcy z Zakładu Chemii i Toksykologii Żywności Instytutu Technologii Żywności i Żywienia Uniwersytetu Rzeszowskiego poszukują nowych wskaźników przydatnych do weryfikacji odmiany miodu zadeklarowanej przez pszczelarza, które mogłyby zastąpić kosztowną i czasochłonną analizę pyłkową. Tym razem w obszarze zainteresowań Zespołu znalazły się aminokwasy i białka. Badania zostały sfinansowane w ramach projektu „Związki azotowe jako nowe narzędzie weryfikacji odmiany i autentykacji pochodzenia miodu” (nr 702/2021) przez Krajowy Ośrodek Wsparcia Rolnictwa w ramach mechanizmu Wspólnej Polityki Rolnej „Wsparcie Rynku Produktów Pszczelich”.

Białka występują w miodach krajowych w niewielkich ilościach (max. 1%), ale ze względu na niską stabilność termiczną mają dużą wartość wskaźnikową. Szczególnie istotną grupę stanowią enzymy, m. in. diastaza (uwzględniona w regulacjach prawnych), inwertaza, oksydaza glukozowa, kwaśna fosfataza. Wśród obecnych w miodzie wolnych aminokwasów dominuje prolina (50% – 80% wszystkich), stosowana do wykrywania zafałszowań miodu. Stężenie białka w miodzie zależy od jego pochodzenia botanicznego i geograficznego, zmienia się także podczas przechowywania i dekrystalizacji miodu. Z kolei profil aminokwasowy jest stosowany do botanicznej klasyfikacji miodów w oparciu o aminokwasy markerowe dla danej odmiany, np. arginina w miodzie kasztanowym oraz tryptofan w miodzie akacjowym.
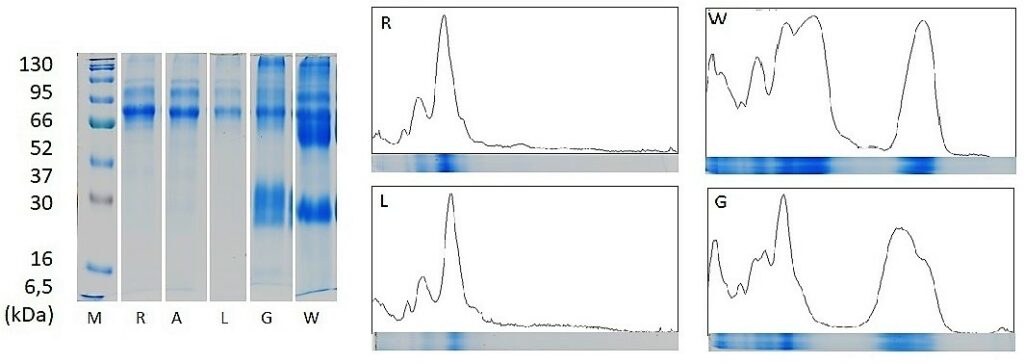
W ramach projektu dokonano oceny 90 próbek miodów ośmiu odmian zakupionych od podkarpackich pszczelarzy (miody lokalne) oraz dostępnych w handlu mieszanek miodów importowanych (komercyjne). Zawartość białka oznaczona metodą Bradforda wynosiła 0,02-0,5g/100g i była zróżnicowana w zależności od pochodzenia i odmiany miodu, najwięcej białka zawierały miody ciemne, a miody lokalne więcej niż komercyjne. Przy użyciu elektroforezy w warunkach denaturujących SDS-PAGE (ang. Sodium Dodecyl Sulfate – PolyAcrylamide Gel Electrophoresis) dokonano frakcjonowania białek miodów, co pozwoliło na skonstruowanie bazy wzorcowych profili dla poszczególnych odmian. Profilowanie białek w metodach elektroforetycznych opiera się na różnicy szybkości migracji zjonizowanych białek w porowatym żelu pod wpływem przyłożonego prądu elektrycznego. Po wybarwieniu żelu uzyskuje się charakterystyczne układy prążków, które można uznać za „odciski palców” (ang. fingerprint) poszczególnych odmian miodu. We wszystkich odmianach powtarzają się pewne prążki (białka odpszczele), ale niektóre odmiany posiadają dodatkowe prążki (roślinne). Uzyskany na żelu układ prążków może być przetworzony komputerowo na wzorcowy profil białkowy (wykres charakteryzujących się różnym układem pików).
Do różnicowania miodów wykorzystano spektrofotometryczne pomiary aktywności enzymów występujących w miodzie, w tym obok diastazy mniej przebadane glikozydazy: α-glukozydaza, β-galaktozydaay, N-acetyloglukozaminidaza i α-mannozydaza. Aktywność enzymów w badanych miodach była zróżnicowana w obrębie danej odmiany, nieco wyższa w miodach lokalnych niż komercyjnych. Z uwagi na obserwowaną wysoką zmienność, aktywność badanych enzymów nie może być uznana za uniwersalny marker odmiany miodu.
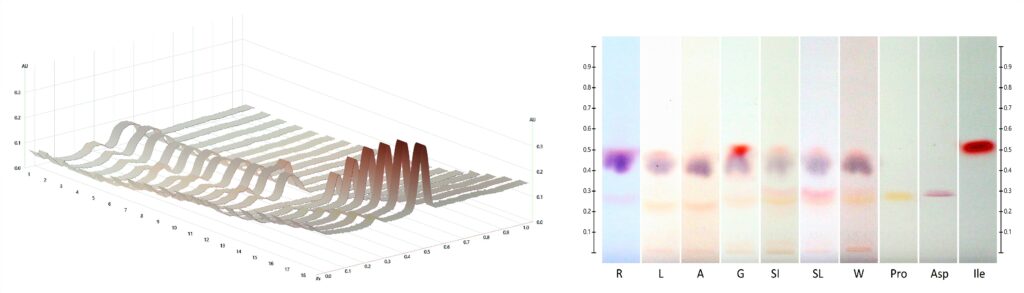
Po raz pierwszy zastosowano wysokosprawną chromatografię cienkowarstwową HPTLC (ang. High Performance Thin Layer Chromatography) do wyznaczenia profili aminokwasowych miodów. Dla wszystkich odmian zidentyfikowano prolinę w zróżnicowanej ilości, a ponadto w mniejszych ilościach inne aminokwasy, głównie izoleucynę (miód gryczany) i kwas asparaginowy (spadziowy ze spadzi liściastej). Wykazano potencjalne zastosowanie metody HPTLC do oznaczania ilościowego proliny w miodzie jako alternatywnej metody dla oznaczenia kolorymetrycznego.
Wyniki przeprowadzonych badań potwierdziły przydatność proponowanych markerów do weryfikacji odmiany miodu i pochodzenia geograficznego oraz możliwość wykorzystania nowoczesnych technik analitycznych do wykrywania zafałszowań miodu. Porównując wzorcowy profil białkowy (liczba i układ prążków) z profilem badanego miodu, można potwierdzić lub poddać w wątpliwość odmianę deklarowaną przez pszczelarza. Jako wskaźniki pomocnicze można zastosować profilowanie aminokwasów i oznaczanie zawartości białka. Proponowana metoda nadaje się do badań przesiewowych (skriningowych), które mogą ograniczyć liczbę próbek wymagających potwierdzenia analizą pyłkową.
Zespół z Uniwersytetu Rzeszowskiego:
dr hab. inż. Małgorzata Dżugan, prof. UR,
dr inż. Michał Miłek,
mgr inż. Ewelina Sidor

